Prueba PCR SARS-CoV-2 (COVID-19)
Los coronavirus son un grupo de virus de ARN que se agrupan en cuatro géneros: Gammacoronavirus, Deltacoronavirus, Alphacoronavirus y Betacoronaviurs, perteneciendo a este último género el SARS-CoV-2, agente causal de la COVID-19.
Los betacoronavirus (así como los alfacoronarvirus) infectan solo a mamíferos y normalmente son responsables de infecciones leves del tracto respiratorio superior en humanos y gastroenteritis en animales. En el caso de las infecciones ocasionadas por SARS-CoV-2 se ha observado que sus efectos pueden variar mucho, debido a una diversidad de factores que aún no se conocen por completo.
Para solicitar la prueba PCR SARS-CoV-2 (COVID-19), puede contactar por teléfono o whatsapp al número
623 00 83 10
o escribir un correo a la siguiente dirección
covid-19@cambricobiotech.com
Estructuralmente, los coronavirus son virus esféricos de 100-160 nm de diámetro, con envuelta y que contienen ARN monocatenario (ssRNA) de polaridad positiva de entre 26 y 32 kilobases de longitud.
El genoma del virus SARS-CoV-2 (MN 908947) consiste en una molécula de ARN mono cadena sentido positivo (ssRNA+) de unos 30 Kb que codifica, entre otras, para cuatro proteínas estructurales; la proteína S (proteína spike), la proteína E (envuelta), la proteína M (membrana) y la proteína N (nucleocapsida), y diversas proteínas funcionales, codificadas por genes organizados en dos marcos de lectura (ORF1 y ORF2), que dan lugar, entre otras proteínas, a la enzima ARN polimerasa dependiente de ARN (RdRp) y la helicasa (Hel). Ref. Chang, T.-J., Yang, D.-M., Wang, M.-L., Liang, K.-H., Tsai, P.-H., Chiou, S.-H., … Wang, C.-T. (2020). Genomic analysis and comparative multiple sequences of SARS-CoV2. Journal of the Chinese Medical Association, 83(6), 537–543.doi:10.1097/jcma.0000000000000335

Mapa genómico de SARScov2.
Ref. https://upload.wikimedia.org/wikipedia/commons/2/2c/Estructura_y_genoma_del_coronavirus_SARS-CoV-2.png
Los sistemas de detección de microorganismos patógenos, como es el caso de virus SARS-CoV-2, se pueden detectar de manera directa, esto es identificando el virus en sí, o de manera indirecta, esto es, detectando la respuesta del sistema inmune como consecuencia de la presencia del virus en el organismo. La detección del genoma vírico mediante RT-PCR sería un ejemplo de metodología de detección directa, al igual que la detección de alguna proteína (antígeno específico del virus). Por otro lado, la detección de diferentes tipos de anticuerpos generados específicamente frente al virus (IgG ó IgM), serían ejemplos de sistemas de detección indirectos.
Todos los sistema mencionados anteriormente presentan ventajas e inconvenientes y la selección de uno u otro dependerá del objetivo perseguido con el diagnóstico (estudio poblacional, cribado masivo, diagnóstico diferencial, etc.).
La siguiente figura muestra el curso de desarrollo normal de la infección, y las fases aproximadas de aparición de las diferentes moléculas diagnósticas (ARN viral en el caso de diagnóstico mediante PCR y anticuerpos específicos, en el caso de los métodos diagnósticos serológicos).
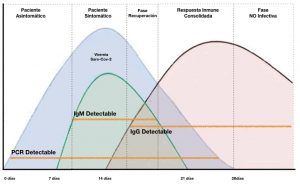
Variación de la carga vírica y los niveles de inmunoglobulinas a lo largo de la enfermedad y su relación con los resultado de los test de diagnóstico.
Ref. Informe diagnóstico Sars-cov-2; Vocalía Nacional de Analistas Clínicos.
https://www.portalfarma.com/Profesionales/campanaspf/Asesoramiento-salud-publica/infeccion-coronavirus-2019-nCoV/Documents/informe-diagnostico-sars-cov-2.pdf
De los sistemas diagnósticos disponibles actualmente, la detección directa del virus mediante RT-PCR se considera como el “gold estándar”, debido a que es la metodología que muestra la mayor sensibilidad y especificidad, es capaz de detectarse incluso en pacientes asintomáticos y no requiere del desarrollo de respuesta inmune por parte del individuo.
En cualquier caso, ya sea el método directo (PCR) o indirecto (serológico), es importante remarcar, que dentro de cada tipología diagnóstica, existen numerosos kits diagnósticos disponibles, que pueden variar significativamente en cuanto a su capacidad de detección (sensibilidad) y su capacidad de distinguir entre sars-cov 2 y otros virus del mismo género o de otros géneros (especificidad).
La identificación de sars-cov 2 mediante RT PCR se basa en dos elementos básicos; por un lado, los genes que se buscan del virus y el sistema molecular empleado (primers y sondas) y por otro el tipo y la calidad de la muestra biológica de partida.
Respecto a los genes y sistemas moleculares diagnósticos empleados, el CDC (Centers for Disease Control and Prevention, U.S. Departement of Health and Human Services), consensuó y estableció diversos sistemas diagnósticos (última actualización el 28 de mayo de 2020), basados en la detección de regiones específicas de gen N. Ref. https://www.cdc.gov/coronavirus/2019-ncov/lab/rt-pcr-panel-primer-probes.html
A estos sistemas, se les fueron sumando nuevos protocolos diagnósticos, que además de ir dirigido al gen N, también tienen como diana otros genes, como el E, S o RdRp, con el objetivo de aumentar la sensibilidad y especificidad, así como de evitar resultados falsos negativos, debido a la aparición de mutaciones, en aquellos casos que tan solo se escrutaba una región diagnóstica.
El segundo elemento crítico en cualquier procedimiento diagnóstico y, particularmente, en la detección mediante RT PCR es el tipo de muestra y la calidad de las mismas. En cuanto al tipo, como ya se ha mencionado, el sars-covi 2 es un virus que coloniza típicamente las vías respiratorias superiores y a medida que la infección avanza, si esta no se controla adecuadamente, también se puede encontrar en otros lugares. Así, se han realizado pruebas de detección mediante RT-PCR en: Exudado/frotis nasofaíngeo/orofaríngeo; Aspirado/lavado nasofaríngeo; iii) Aspirado endotraqueal; iv) Esputo; Biopsia pulmón; Orina y heces.
Para la mayoría de aplicaciones diagnósticas, se emplean frotis nasofaríngeos y orofaringeos, debido a la facilidad de toma a la concentración del virus. No obstante, en casos de clínica compatible y resultado de PCR negativo, se puede realizar estudios a partir de otro tipo de muestras con mayor carga viral.
Además del tipo de muestra, para garantizar un correcto resultado diagnóstico en el menor tiempo posible, es imprescindible que la toma tenga el contenido celular suficiente y que el almacenamiento y transporte sea el adecuado. Esto es particularmente importante en aquellos casos en los que se trata de autotoma, ya que en estos casos, es frecuente que las tomas no se hagan con el vigor necesario y que el contenido celular esté por debajo de los umbrales de detección, dando lugar a “Resultados no válidos” o “Resultados No concluyentes”, que requieren una nueva toma.
El resultado del estudio de PCR será uno de los tres siguientes:
Resultado positivo: – Un resultado positivo de la PCR significa que la persona de la que se tomó la muestra está actualmente infectada por el virus.
En este caso, tendrá que ponerse en contacto con su sistema de salud y seguir las recomendaciones indicadas
Resultado negativo de la prueba: – Un resultado negativo de PCR podría significar que: la persona no está infectada actualmente por este virus, o que el virus no está presente en el lugar donde se tomó la muestra, o bien no está presente con una carga viral detectable por la metodología empleada.
Resultado no valido: – Un resultado no valido indica que no se ha podido extraer material genético de la muestra, debido a que esta no tenía suficientes células o a que las mismas se degradaron durante el proceso de toma y/o transporte. En este caso, se requerirá una nueva toma para la repetición del estudio.
Recordar que la prueba RT-PCR no puede detectar si una persona ha tenido el virus y superó la enfermedad COVID-19, ya que solo detecta cuando hay virus activo. Para saber si una persona ha pasado la enfermedad sería necesario la realización de un estudio serológico, aunque aún así es importante tener presente la limitaciones del mismo (no todo el mundo desarrolla anticuerpos y el título de los mismos decae a través del tiempo).
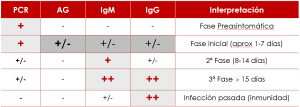
Así, combinando estudios de PCR y serológicos, la información general que se obtendría de los mismos es la siguiente:
Para solicitar la prueba, puede contactar por teléfono o whatsapp al número
623 00 83 10
o escribir un correo a la siguiente dirección
covid-19@cambricobiotech.com
